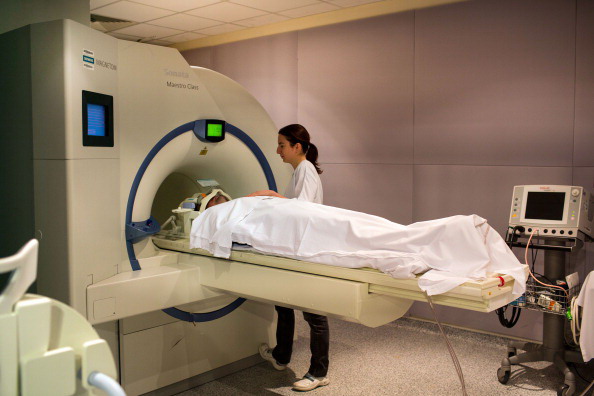
«Testate i nuovi antitumorali sui bambini malati di cancro»
12/02/2014 di Dario Ferri

I buchi della legislazione europea consentono alle aziende farmaceutiche di non testare sui bambini malati di cancro medicine che potrebbero salvargli la vita. La denuncia arriva da un centro di ricerca inglese, che chiede una modifica delle legislazione al fine di garantire questa chance di salvezza ai giovanissimi colpiti dal tumore.
ACCUSE ALL’UE – Come riporta il sito della TV pubblica più prestigiosa al mondo, la britannica BBC, l’accusa all’Unione Europea proviene da un rinomato centro di cura, Institute of Cancer Research, ICR, che fa parte dell’Università di Londra. I ricercatori dell’ICR richiedono, insieme al francese Consortium for Innovative Therapies for Children with Cancer, che la legislazione comunitaria venga modificata. In questo modo si potrebbero salvare molte giovani vite, oppure quantomeno prolungarla, come rimarcano i ricercatori inglesi e francesi. Molte medicine che vengono sviluppate per gli adulti potrebbero infatti funzionare anche sui bambini, se fossero testate in modo adeguato con studi scientifici appropriati. Questa è la tesi esposta da Louis Chesler dell’ICR, che oltre che ricercatore è anche un oncologo specializzato nella cura dei più piccoli. Secondo il centro britannico infatti ora le multinazionali farmaceutiche hanno molti modi per sfuggire a questi test, consentiti proprio dai buchi normativi della legislazione comunitaria afferente ai servizi e merci sanitarie.
BUCO COMUNITARIO – La responsabilità di questa situazione è infatti frutto di un’eccezione consentita dalla normativa UE. Le medicine antitumorali non devono infatti essere testate sui pazienti al di sotto dei 18 anni, se sono state sviluppate contro una forma di cancro che non è ancora stata riscontrata tra i bambini. Un’eccezione che però penalizza i pazienti più giovani, perché secondo l’ICR simili cure potrebbero essere efficaci anche per i bambini. Un esempio citato dai ricercatori è ad esempio la cura per il tumore ai polmoni, che potrebbero essere utile anche contro il neuroblastoma, la forma di cancro che più si riscontra tra i bambini, spesso purtroppo con esiti molto dolorosi e mortali. Dal 2007 28 medicine sviluppate per pazienti malati di cancro di età adulta hanno mostrato meccanismi efficaci anche per la cura dei più piccoli, rimarca l’ICR. 14 di questi medicine non sono però mai state sottoposte a test con pazienti under 18, perché i bambini non avevano sviluppato la forma tumorale per la quale erano state concepite queste cure.
LEGGI ANCHE – La bufala del forno a microonde che provoca il cancro
REGOLE ANTIQUATE – Il responsabile dell’ICR Alan Ashworth ha ribadito come i bambini non abbiano accesso a medicine, che sono disponibili grazie a studi clinici che confermano le loro qualità. Anche se gli scienziati ritengono che queste cure possano allungare la vita, esse non possono essere testate sui pazienti più piccoli, ha sottolineato con forza Ashworth. «Riteniamo che il sistema regolamentare dell’Unione Europea sia drammaticamente antiquato, e non mantenga il passo di cosa sia l’attuale ricerca sul cancro». Il quotidiano austriaco Krone Zeitung rimarca come originariamente le regole dell’UE siano state pensate per proteggere i bambini malati di cancro. I piccoli non avrebbero dovuto sottoporsi a test non necessari e di conseguenza subire trattamenti o cure che già in partenza si sarebbero rivelati inefficaci nel contrastare la loro malattia. Questa impostazione non sarebbe però più adeguata a quanto successo nella ricerca medica in questi anni. Per questo l’ICR chiede all’UE di modificare rapidamente le proprie regole.
STIMOLO FINANZIARIO – Il centro di ricerca dell’Università di Londra chiede all’UE di introdurre una modifica normativa che consenta i test sui bambini affetti di tumore, al fine di sfruttare le nuove innovazioni nella cura contro il cancro. Per fare questo è però necessario che le aziende farmaceutiche ricevano un incentivo finanziario per questo tipo di ricerca. Quando un determinato trattamento è brevettato per l’utilizzo ai soli pazienti adulti, un dottore può anche prescriverlo ai bambini « off-label», ma senza adeguata ricerca clinica che sostenga il suo utilizzo, le assicurazioni sanitarie potrebbero non essere intenzionate a pagarle.